![]()
Het element zuurstof
![]()
Het element zuurstof

Ontdekking
 Karl Wilhelm Scheele |
Zuurstof werd in 1771 door de Zweedse apotheker Karl Wilhelm Scheele ontdekt, maar de herontdekking door Joseph Priestley maakte het pas in wijdere kring bekend. Men begreep al gauw dat dit gas, hoewel het maar een vijfde van de lucht van onze planeet uitmaakt, verbranding mogelijk maakt alsmede het ademen van mens en dier (en plant gedurende de duisternis). |  Joseph Priestley |
Naam
| Het was Antoine Lavoisier die het zijn wetenschappelijke naam zuurstof afkomstig van de Griekse woorden oxys en geinomai (Lat. Oxygenium) wat zuurvormen/zuurvormer betekent gegeven heeft. Aanvankelijk dacht men dat het element een onontbeerlijk bestanddeel van een zuur was. Hoewel oxides van vele elementen inderdaad zuurvormend zijn, is het omgekeerde niet waar: om een zuur te vormen is zuurstof niet noodzakelijk. |  Antoine Lavoisier |
Voorkomen
Het bekendste gegeven i.v.m.
het voorkomen van zuurstofgas is dat het ongeveer 1/5 van het volume van
de lucht vormt. (20,9 vol%)
Zuurstof is naar voorkomen het eerste element in de aardkorst, het maakt
daar ongeveer 46,7 massa% van uit, het meest in de vorm van metaaloxiden,
silicaten, carbonaten en andere zouten. Ook van de oceanen is het het hoofdbestanddeel
(87 massa%), omdat het een van de twee elementen is waaruit water (H2O)
bestaat. Hetzelfde geldt voor het ijs waaruit o.a. de poolkappen hier op
aarde bestaan.
Op andere hemellichamen, bijvoorbeeld Mars, bestaat het ijs mogelijk uit
koolstofdioxide, dat overigens ook zuurstof bevat. Jupiters maan Europa
is geheel bedekt met waterijs en kometen bestaan grotendeels uit waterijs.
Het feit dat zuurstof in vrije vorm in de atmosfeer voorkomt, is een effect
van het leven op aarde en met name de fotosynthese van groene planten. Zonder
de voortdurende aanmaak zou het element weer geleidelijk uit de atmosfeer
verdwijnen, omdat het vrij reactief is en zich met oxideerbare materialen
zou verbinden. Bosbranden zijn daar een goed voorbeeld van.
Isotopen
Isotoop |
% |
x |
15O |
synthetisch |
122,24
s halveringstijd |
16O |
99,762 |
stabiel
met 8 neutronen |
17O |
0,038 |
stabiel
met 9 neutronen |
18O |
0,200 |
stabiel
met 10 neutronen |
Naast het meest voorkomende zuurstofisotoop 16O komen er nog twee andere stabiele isotopen voor: 17O en 18O. Tevens zijn er een tiental radioactieve isotopen bekend met halfwaardetijden van minder dan drie minuten.
Dizuurstof - Zuurstofgas - O2
Zuurstofgas is de verschijningsvorm van de enkelvoudige stof bij de hier op aarde heersende temperatuur en druk.
Fysische eigenschappen
Het is een kleurloos en reukloos gas, dat de eigenschap heeft een smeulend houtspaandertje terug te doen ontvlammen. De dichtheid r = 1,429 g/L. De zwakke intermoleculaire londonkrachten zorgen voor een smeltpunt van –218°C en een kookpunt van –183°C. Bij n.o. lost 49,1 mL gas op in 1 liter water. Vloeibaar dizuurstof heeft de blauwe kleur.
Bereiding
Het zuiverste zuurstofgas wordt bereid door elektrolyse van water met gescheiden anode- en kathoderuimten. Als elektroden gebruikt men vooral platina, maar ijzer en nikkel zijn eveneens geschikt. Aan de anode ontstaat dizuurstof (O2) en aan de kathode diwaterstof (H2).
In het labo wordt O2 bereid door:
 2 Hg(vl)
+ O2(g)
2 Hg(vl)
+ O2(g)
 3 KClO4(v)
+ KCl
3 KClO4(v)
+ KCl 2 KCl(v)
+ 6 O2(g)
+ energie
2 KCl(v)
+ 6 O2(g)
+ energie 2 KCl(v)
+ 3 O2(g)
(het bruinsteen en de ijzeroxiden fungeren als katalysatoren).
2 KCl(v)
+ 3 O2(g)
(het bruinsteen en de ijzeroxiden fungeren als katalysatoren). 2 MnSO4(v)
+ 2 H2O + O2(g)
2 MnSO4(v)
+ 2 H2O + O2(g) 4 HF(g)
+ O2(g)
4 HF(g)
+ O2(g)
Op grote schaal verkrijgt men technisch zuurstofgas door gefractioneerde destillatie van vloeibare lucht of door membraanscheiding.
Men kan gas-gasmengsels, zoals lucht, ook in de gasfase scheiden door ze over een serie membraanseparatoren te leiden. Dergelijke membranen zijn opgebouwd uit bundels holle polymeerbuizen. Gassen kunnen diffunderen door de wanden van deze polymeerbuizen. De grootte van de mazen in deze wanden bepaalt welke gasdeeltjes (moleculen) gemakkelijker worden doorgelaten en welke moeilijker. Zo is de doorlaatbaarheid voor zuurstofgas voor de meeste membraantypes groter dan voor stikstofgas, gelet op de verschillen in afmetingen van de moleculen. De verhouding van het aantal doorgelaten zuurstofgasmoleculen tot het aantal doorgelaten stikstofgasmoleculen bepaalt de selectiviteit van het membraan en dient minimaal vier te zijn. Deze verhouding wordt de selectiviteit of de scheidingsfactor van het membraan genoemd. In de praktijk betekent dit dat het gasmengsel meestal door meerdere membranen moet diffunderen om een zo volledig mogelijke scheiding te verkrijgen. De snelheid van het scheidingsproces kan opgedreven worden door een combinatie van drukverhoging (van 0.7 MPa tot 10 MPa) en temperatuurverhoging (van kamertemperatuur tot 95 °C). De doorlaatbaarheid van deze membranen voor zuurstofgas is steeds groter dan voor stikstofgas : een zuurstofgasmolecule heeft namelijk een kleiner volume (22,467.10-30 m3 ) dan een stikstofgasmolecule (23,647.10-30 m3 ).
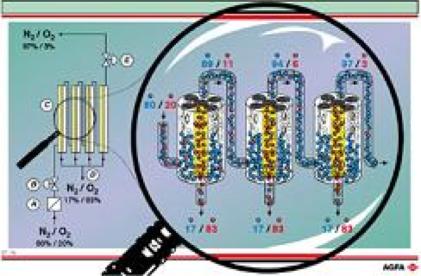
Membraanseparator
Onderaan links wordt het binnenkomende luchtmengsel gecomprimeerd (A). Via
een regelkraan (B) wordt het gasmengsel toegelaten tot de membraanseparatoren
(C). Onderaan de separator (D) wordt het met zuurstofgas aangerijkte luchtmengsel
afgevoerd. Bovenaan de separator wordt bijna zuiver stikstofgas afgevoerd
via een regelkraan (E).
Zuurstofgas wordt in de natuur
op grote schaal geproduceerd door groene planten via fotosynthese. Hierbij
wordt de zuurstof uit water omgezet in elementaire zuurstof, met behulp
van CO2 uit de lucht en zonlicht.
6CO2 + 6H2O
-> C6H12O6
+ 6O2 (lichtenergie + chlorofyl)
Chemische eigenschappen
Zuurstofgas verbindt zich
met alle elementen behalve de edelgassen. Deze verbindingen worden oxiden
genoemd. De omstandigheden waarin de verbindingen met zuurstofgas gevormd
worden zijn zeer verschillend. Sommige elementen reageren reeds bij kamertemperatuur.
Vele branden in zuurstofgas bij temperatuurverhoging (H2,
S8 e.a.). Vele andere elementen reageren
slechts langzaam, zelfs bij verwarmen, terwijl enkele edele metalen niet
rechtstreeks met zuurstofgas verbindingen aangaan en alleen langs een omweg
metaaloxiden vormen. Deze (Pt, Ir, Au, Ag) mag men met zuurstofgas zonder
gevaar verwarmen.
Zuurstofgas is een oxiderende stof. C, H2,
Fe, Cu, e.a. worden door O2 geoxideerd.
Zij treden op als reducerende stoffen.
Sommige oxidaties gaan gepaard met grote warmteontwikkeling en lichtuitstraling.
Dergelijke verbrandingen van allerlei brandstoffen worden snelle oxidaties
genoemd. Het roesten van ijzer aan de lucht, het verbranden van voedingsstoffen
met de opgenomen zuurstof door dieren worden trage oxidaties genoemd.
In zuivere zuurstof gaan de verbrandingen sneller dan aan de lucht en met
meer warmte ontwikkeling. Vandaar het gebruik van zuiver zuurstofgas in
branders voor het autogeen lassen van bijv. ijzer.
De snelheid van verbranden hangt af van de temperatuur, de druk van de zuurstof,
de verdelingsgraad der brandbare stof en de aanwezigheid van katalysatoren.
Fijn verdeelde stoffen branden sneller(stofontploffingen in mijnen en graansillo’s),
het branden van fijn verdeeld ijzer, aluminium, koper e.a. in de bunsenvlam.
Sommige stoffen zoals mangaanoxiden katalyseren de oxidaties, andere de
fenolen, vertragen de oxidatie met zuurstofgas. Men noemt ze antioxiderende
stoffen.
Toepassingen